1.4 KiB
Executable file
VSEPR theorie
De valentieschil-elektronenpaar-repulsie theorie is een theorie die de geometrie van covalente binding verklaart aan de hand van elektrostatische repulse tussen valentie-elektronen. De theorie gaat ervan uit dat de atomen in een molecuul zich rond één centraal atoom bevinden.
Omringingsgetal
Het omringingsgetal ook wel sterisch getal van een atoom is de som van vrije- en gemeenschappelijke elektronenparen. Waarbij alle soorten binding tellen als één.
| Omringingsgetal | Moleculair-geometrische basisconfiguratie |
|---|---|
| 2 | Lineair |
| 3 | Trigonaal planair |
| 4 | Tetraëdrisch |
| 5 | Trigonaal bipiramidaal |
| 6 | Octaëdrisch |
Dipoolmoleculen
Een molecuul wordt een dipoolmolecuul genoemd als de onderlinge binding tussen de atomen dipool-dipool bindingen zijn en er geen samenval van partiële lading is. Zoals bij \mathrm{CO_2} het geval is. Om dit te beoordelen is de VSEPR theorie benodigt.
Afwijkende tetraëderhoek
De afwijkende tetraëderhoek van bijvoorbeeld \mathrm{H_2O} komt uit feit dat vrije elektronen elkaar meer afstoten dan gemeenschappelijke elektronenparen. Waarom?
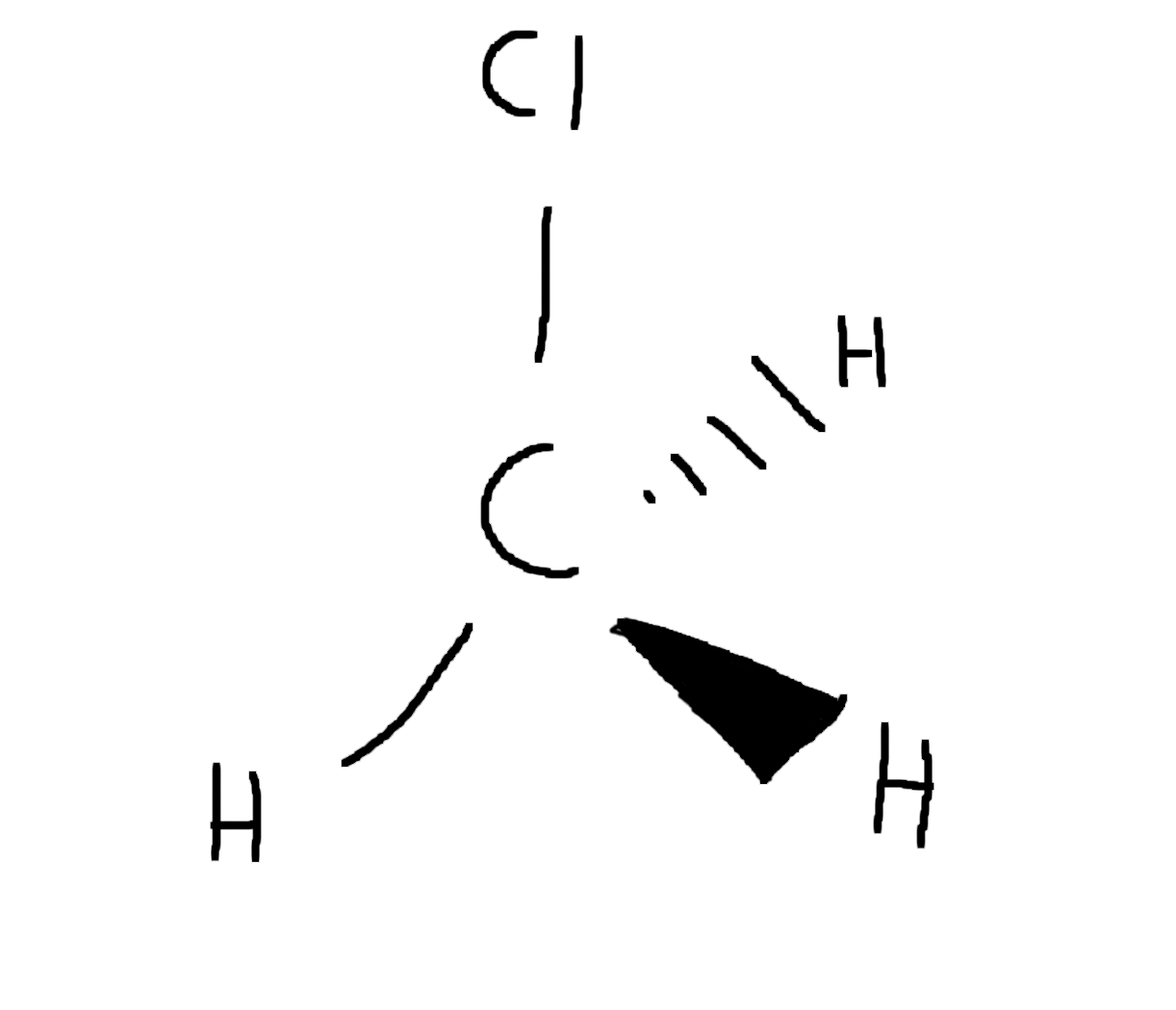
Voorbeeld VSEPR theorie
Het omringingsgetal van het koolstof (\mathrm{C}) atoom van chloormethaan (\mathrm{CH_3Cl}) is 4. Hierdoor is het chloormethaan molecuul tetraëder met 4 gelijkzijdige hoeken.